
日前,长生生物的疫苗问题,再次引爆了朋友圈。
在小新的朋友圈里,不少朋友都在翻自己和孩子的疫苗接种记录。
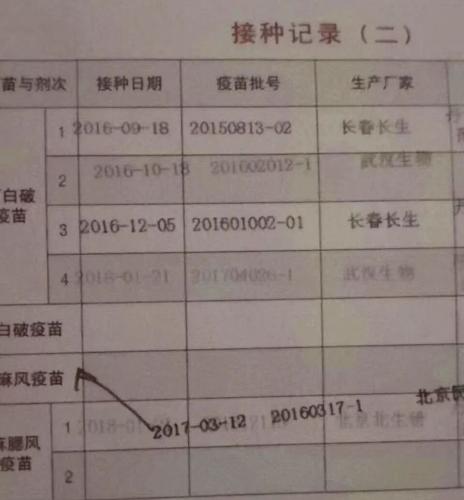
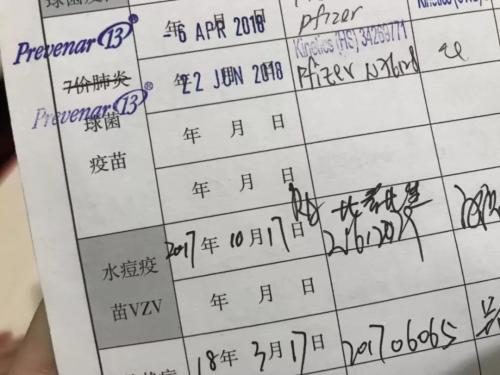
朋友圈截图
7月15日,国家药品监督管理局官方网站发布通告,发现长春长生生物科技有限责任公司生产的冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》行为。
一波未平,一波又起。
7月19日晚,长生生物在深交所发布公告称,7月18日,长生生物科技股份有限公司全资子公司长春长生生物科技有限责任公司收到《吉林省食品药品监督管理局行政处罚决定书》(下称《处罚决定书》),并被吉林食药监管局合计罚款344万余元。

处罚决定书内容摘选截图。来源:吉林省食药监局网站
《处罚决定书》称,在国家药品专项抽检中,长春长生生物科技有限责任公司生产的“吸附无细胞百白破联合疫苗”经中国食品药品检定研究院检验,检验结果【效价测定】项不符合规定。长春长生生物科技有限责任公司生产的上述药品符合《中华人民共和国药品管理法》第四十九条第三款第六项“其他不符合药品标准规定的;”规定的情形,应按劣药论处。
疫苗安全,人命关天。而那些自己的孩子很有可能已经被注射了问题疫苗的母亲们的呐喊更令人心惊。
短短一周内,长春长生两次因疫苗问题被推上舆论的风口浪尖,其背后,究竟有什么秘密?

资料图:山西太原卫生监督工作人员针对第二类疫苗进行专项检查。程海龙摄
处罚决定书九个月后公布,因为舆论压力?
小新注意到,这件事情的时间节点也颇值得思考。
7月15日,国家药监局通报了长生生物子公司长春长生狂犬病疫苗生产记录造假问题,问题疫苗的盖子因内部人举报而揭开。
7月19日,长生生物发布公告,收到关于“百白破”疫苗旧案的处罚决定书。
7月20日,吉林省食药监局在官网公开了这一决定书,落款处日期是7月18号。
略显蹊跷的是,吉林省食药监局早在去年10月27日就已对此立案调查,这一事件当时也曾引发舆论关注。此外,作为一家上市公司,长生生物却从没有在之前的公告及2017年年报中对此予以披露。
这一决定的作出,距离旧案立案,已过近9个月之久;而距离狂犬病疫苗事发,仅过了三天。

长生生物官网对其吸附无细胞百白破联合疫苗的介绍。
这些疫苗流向何方?
这批百日破的疫苗流向何方?想必这是民众最为关心的问题。
吉林省食药监局的《处罚决定书》称,“经查明,该批药品生产数量共253338支,由吉林省药品检验所抽样552支,销售到山东省疾病预防控制中心252600支,现库存186支。”
那么,山东这些疫苗又去了哪?
公开报道中,《新京报》一篇发表于去年11月5日的报道有所提及——报道引述山东食药监局市场处负责人的话说:1、有关部门正开展召回工作;2、问题药品已全部封存。3、这批药安全性没问题,是效价不达标,目前没发现接种这批疫苗出现问题的案例。

资料图:家长带着儿童在排队等候接种疫苗。韦亮 摄
打了问题疫苗怎么办?
根据中国疾控中心官网去年11月发布的《效价指标不合格的百白破疫苗相关问题解答》,儿童家长或监护人可以查看儿童预防接种证上的百白破疫苗接种记录,与公布的疫苗生产企业和批号进行对照,判断是否接种了相应批号的不合格百白破疫苗。
同时,儿童家长或监护人还可以咨询接种单位,由接种单位协助查询所接种百白破疫苗的批号,判断是否接种了相应批号的不合格百白破疫苗。还可以拨打12320卫生热线咨询。
就在今天,北京市疾控中心发出消息,对于长生生物这两个出问题的疫苗,北京市均未采购,公众可以放心接种疫苗。

资料图 韦亮 摄
疫苗大案,道歉处罚就能了事?
长生生物的吸附无细胞百白破联合疫苗违反“禁止生产、销售劣药”规定,被吉林食药监管局合计罚款344万元,具体如下:
1、没收库存的“吸附无细胞百白破联合疫苗”(批号:201605014-01)186支。
2、没收违法所得858840.00元。
3、处违法生产药品货值金额三倍罚款2584047.60元。罚没款总计3442887.60元。
同时,小新注意到,长生生物股价20日更是五连跌停,市值蒸发97.86亿元,控股股东高俊芳身价锐减17.71亿元。
而针对此前备受舆论关注的“狂犬疫苗案”,此前,7月17日,长春长生发布声明,表示已按要求停止狂犬疫苗的生产,并“深表歉意”。
但对于长生生物的道歉和吉林省药监局的处罚决定,不少网友并不买账。在不少网友看来,这次的处罚,的确是有点“太轻了”。
监管为何屡屡失灵?
回顾整件案情,监管,也成为了舆论的聚焦点。
从两年前震惊全国的山东疫苗案,到去年的长春“百白破”案,再到如今疫苗问题的再度发酵……人命关天的疫苗,为何监管屡屡失守?
公众需要真相,违法者需要严惩! (冷昊阳)
相关报道:
中新经纬客户端7月22日电 长生生物“狂犬病疫苗造假”事件持续发酵,那25万支劣质药流向何处了?众所周知,狂犬病的死亡率几乎为100%,事关人命,一连串待解的疑问都让公众神经紧绷……
中新经纬客户端(微信公众号:jwview)梳理发现,目前,人民日报、光明日报、央视网、检察日报、中央人民广播电台等五家官媒相继就该事件发表评论,并将质疑指向问题疫苗流向、长生生物是否隐瞒事实、监管为何频频失守等焦点问题。
事件:一周内被曝两种疫苗造假
简单梳理事件经过便不难发现,在短短一周的时间内,长生生物两次被曝疫苗造假:7月15日,国家药品监督管理局官方网站发布通告,长春长生生物科技有限责任公司(以下简称长春长生)生产的冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》行为。
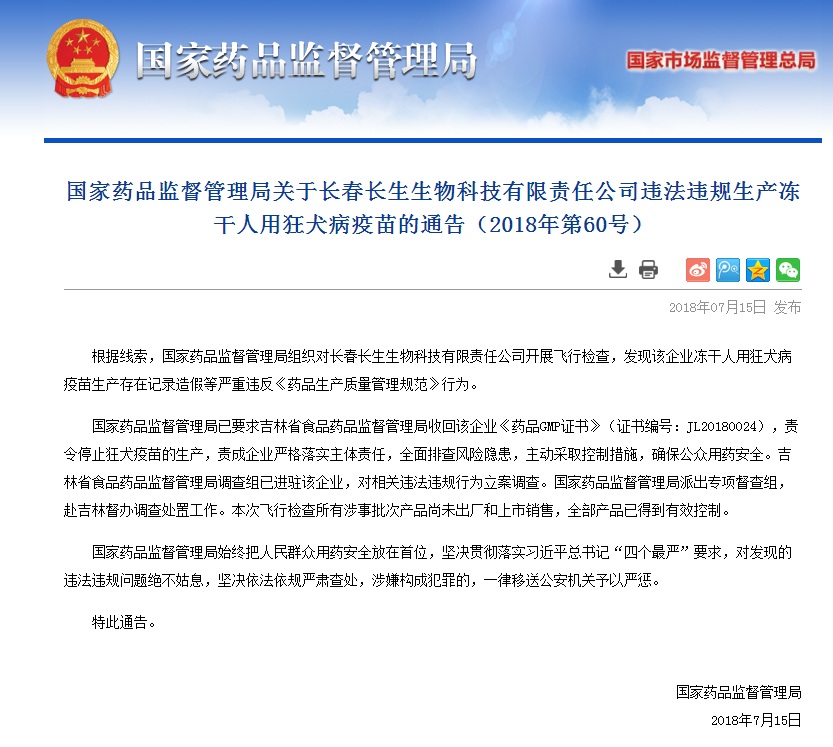
截图来源:国家食药监局网站
7月17日,长春长生官网发布声明,要求立即停止使用、就地封存该公司冻干人用狂犬病疫苗,并启动召回程序。
然而一波未平,一波又起。19日晚,长生生物又发公告称,全资子公司长春长生因“吸附无细胞百白破联合疫苗”(简称“百白破”)检验不符合规定,被吉林食药监管局合计罚款344万余元。
据了解,百白破联合疫苗,是一种儿童疫苗,用于预防百日咳、白喉、破伤风三种疾病,接种对象为(3~24)个月龄儿童,接种不良反应发生率居所有疫苗之首。
如今,几乎每个孩子都要接种很多疫苗,所以疫苗出了问题自然牵动无数家长神经,于是我们看到网络上,很多家长的恐慌、愤怒情绪不断蔓延。这两天,也有许多家长都在恐慌中翻找自家孩子的疫苗本,看看是否接种过长春长生公司的疫苗。

来源:南方都市报
舆论——多家官媒痛批长生问题疫苗
疫苗无小事,官媒频频发声。中新经纬客户端(微信公众号:jwview)梳理发现,目前,人民日报、光明日报、央视网、最高检主管的检查日报、中央人民广播电台等五家官媒相继就该事件发表评论,摘录如下:

中新经纬 摄
人民日报:一查到底,方可纾解疫苗焦虑
疫苗事关生命健康,质量安全容不得半点瑕疵,不能有一点侥幸。此次疫苗事件引来广泛关注之后,很多人在朋友圈晒出自家孩子的疫苗接种记录,可见公众对此事高度重视,也再一次提醒相关机构加强监管、提醒相关企业不要触碰“红线”。
对于问题疫苗,发现一起查处一起很重要;但更重要的是在每次事件中找到问题的根源,否则就会陷于“亡羊补牢”的被动之中。从这个角度看,问题的出现,也是改革的契机。在疫苗的生产、销售过程中,是不是还存在监管漏洞?如何强化事前事中事后的全链条监管,形成疫苗安全管理的长效机制?如何加强处罚力度,让企业不想、不能、不敢有违法行为?不仅要严肃追责涉事药企,更要规范市场秩序、完善监管制度,避免类似事件再次上演。
人民日报海外版:关于疫苗,公众的恐慌该如何平息?
到底是什么造就了这样的恐惧,又该如何平息这样的恐惧?
我们也不知道答案。只知道,如果再有人把责任归咎于舆论管控不力,只会吞下更多苦果。
一个正常的疫苗事件处置——假如这玩意真的存在的话——应该是这样的,主管部门出来说经过一年的调查,我们已经掌握了一些这样的信息。而不是一脸懵懂的告诉公众,我们也在等待各地摸清情况上报。
几乎所有的危机公关原则,都被有些部门漠视了。这才是为何昨天与今天,疫苗事件成为企业公众号、自媒体和一些谣言狂欢的温床。甚至,一个像老童生一样教读者“殇”字用得对不对的帖子都能成为舆论热点,就是不见真正权威的回复。这感觉像极了在戏园子看戏,主角迟迟不出来,台下几个按捺不住的观众扭作一团演给你看。
央视网:人用狂犬病疫苗生产记录造假三大疑问解答
造假如何暴露的?
首先:疫苗的问题怎么发现的?根据7月15日国家药品监督管理局发布的通告,之所以发现问题是“根据线索,对长春长生开展飞行检查”。
何为“飞行检查”
还有:那么什么是“飞行检查”?飞行检查其实就是突击检查,具有很强的保密性、高效性。尤其是针对举报实施的检查,与以往事先通知被检查企业的跟踪检查相比,飞行检查是一种破除地方保护、揭露并打击行业潜规则、严厉惩戒违法违规行为的强有力手段。
哪些记录出现造假?正在调查中
另外就是,发现了什么问题?国家药品监督管理局通告称是发现该企业冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》行为。那么生产过程中的哪些记录出现造假?目前仍在调查中。不过,目前吉林省食品药品监督管理局已收回该企业《药品GMP证书》,这也就意味着该厂申请的冻干人用狂犬病疫苗已经停产。
目前国家药品监督管理局已经派出专项督查组,赴吉林督办调查处置工作。相关的调查结果我们也会持续关注。
光明日报:“狂犬病疫苗记录造假”,没有不良反应也该问责
光明日报刊发了法律学者杨晨的署名文章《“狂犬病疫苗记录造假”,没有不良反应也该问责》:
在事故抑或隐患面前,依法追责既是惩罚,也是警示。尽管这起疫苗记录造假,没有“对人体健康造成严重危害”,或不能追究刑事责任,但也少不了行政责任。根据《药品管理法》,药品的生产企业未按照规定实施《药品生产质量管理规范》的,给予警告,责令限期改正;逾期不改正的,责令停产、停业整顿,并处五千元以上二万元以下的罚款;情节严重的,吊销《药品生产许可证》的资格。如以生产劣药论,不仅“并处违法生产、销售药品货值金额一倍以上三倍以下的罚款”“撤销药品批准证明文件”等,责任人员“十年内不得从事药品生产、经营活动”。
自2011年3月1日起施行的GMP(药品生产质量管理规范),是一套适用于制药等行业的强制性标准,目的是及时主动防范质量事故,以最大限度保证上市药品质量,保证公众用药安全。从2010年的“山西疫苗事件”,到2016年的“山东疫苗事件”,再到这次“狂犬病疫苗记录造假”,安全警钟屡屡敲响。对此,药品监管部门应一查到底,该问责的问责,该整改的整改,把药品隐患扼杀于萌芽阶段。
检察日报:疫苗生产记录造假,致歉就能了事?
虽然针对生产记录造假,国家药品监督管理局已对长春长生进行了行政处罚,但该企业声称的该公司所有狂犬疫苗“没有发生过因产品质量问题引起不良反应事件”,也不能排除该企业有构成刑事犯罪的可能性。
“药企为何会屡教不改?关键在于药企的违法成本太低,罚了款、换个药名又继续经营。”中国人民大学教授、中国消费者协会副会长刘俊海说,要达到处理一个教育一片的效果,就必须抓住典型,依法从严处理。一旦长春长生构成刑事犯罪,除了要承担相应的刑事责任,还要严格落实行业禁入制度。
中国之声四问长生生物:25万支劣药今何在?
一问:为何时隔近9个月才公布处罚决定?
7月19日,长生生物发布公告,收到关于“百白破”疫苗旧案的处罚决定书。
7月20日,吉林省食药监局在官网公开了这一决定书,落款处日期是7月18号。
这一决定的作出,距离旧案立案,已过近9个月之久;而距离狂犬病疫苗事发,仅过了三天。这样的时间安排是出于怎样的考虑?
二问:问题疫苗去哪儿了?
处罚决定书中写道,没收库存的剩余疫苗186支。但在库存之外,已有252600支问题疫苗销售到山东省疾病预防控制中心。这些疫苗去哪了?
三问:长生生物是否有所隐瞒?
根据《上市公司信息披露管理办法》:当公司涉嫌违法违规被有权机关调查,投资者尚未得知时,上市公司应当立即披露,说明事件的起因、目前的状态和可能产生的影响。但直到三天前,长生生物才打破沉默,披露了处罚事项,并承认百白破生产车间已经停产。
四问:吉林省食药监局处罚是否过轻?
处罚决定书显示,对于涉事百白破疫苗,共没收违法所得85.88万元,并处违法生产药品货值金额三倍罚款258.4万元。25万支问题疫苗,加起来才罚了344.29万元,质疑声不少。
追踪——多地通报是否流入问题疫苗
7月15日,国家药品监督管理局官网通报,长春长生违法违规生产冻干人用狂犬病疫苗,被药监局收回GMP证书,并立案调查,涉事批次产品尚未出厂和上市销售,目前全部产品已经得到有效控制。
来源:中新网
然而,一纸公告并不能完全抚平公众担忧,尤其是家长,再次担忧起问题疫苗是否会流入自己所在的省份。中新经纬客户端(微信公众号:jwview)整理发现,目前北京、天津、上海、广东等多地疾控部门都作出了回应,称暂无问题疫苗流入,民众可以放心接种。
7月22日,北京市疾控中心表示,对于长生生物这两个出问题的疫苗,北京市均未采购,公众可以放心接种疫苗。
同日,天津市疾病预防控制中心有关负责人表示,天津市未采购长春长生生产的狂犬病疫苗。
湖南省疾控中心也对媒体表示,湖南境内没有涉事疫苗。
19日,山西省疾控回应称,目前,山西各接种点已停止使用长春长生狂犬病疫苗。
18日,上海市疾病预防控制中心称,目前上海已全面停用长春长生生产的狂犬病疫苗。
公开报道显示,2017年11月,长春长生的另一个疫苗产品——百白破疫苗被原食药监总局通报在药品抽样检查中,检出其一个批次产品效价指标不符合标准规定。经查,长春长生生产的该批次疫苗共计25.26万支,全部销往山东省疾病预防控制中心。
而据山东省当地多家媒体报道,山东省已经全面停用长春长生生物科技有限责任公司生产的人用狂犬病疫苗。进一步的消息,需等待国家药监部门和疫苗生产企业的后续通知。
18日,青岛市疾控中心表示,存在记录造假的疫苗产品并没有销售到市场,已经上市的疫苗的安全性不会存在问题。去年11月份的问题疫苗虽然销往山东,但青岛并没有该批次的疫苗,请市民放心。
此前,广东省疾控中心在16日表示,此次飞行检查的所有涉事批次产品尚未出厂和上市销售,全部产品已得到有效控制,广东没有涉事批次疫苗。同时,广东省疾控中心专家指出,目前召回疫苗是企业主动行为,暂未收到食药监部门的暂停使用该企业所有狂犬疫苗的通知。
需注意的是,已经接种了长春长生狂犬病疫苗的患者该怎么办?多地疾控部门提示,如已接种了长春长生狂犬疫苗部分剂次,按照技术指南,可选择同样采用“五针法”的其他品牌狂犬病疫苗,按照0天、3天、7天、14天、28天各接种1剂疫苗的程序,完成后续剂次接种。(中新经纬APP)(董湘依)


